Magyarország veszélyhelyzeti törvénykezését bírálják nemzetközi gyógyszergyártó szervezetek, és emiatt az amerikai elnök hivatalához fordultak - írja a HVG. Az amerikai gyógyszerkutatók és -gyártók szövetsége (PhRMA), a Biotechnológiai Innovációs Szervezet (BIO) és más tömörülések Joe Bidennek írt levelükben elsősorban azoknak a feltörekvő országoknak a gyakorlatát kifogásolták, amelyek a szellemi tulajdon védelmét figyelmen kívül hagyva vágtak bele a Covid-19 elleni vakcina gyártásába.
Miközben a vállalatok hangsúlyozták, hogy maguk is részt vesznek az oltóanyagok igazságosabb elosztására hivatott, Covax nevű globális programban, kifogásolták, hogy India és Dél-Afrika a szellemi tulajdonjogra vonatkozó nemzetközi egyezmények felfüggesztését szorgalmazta, hogy fel lehessen pörgetni a vakcinák előállítását. A szegényebb országok amiatt aggódnak ugyanis, hogy az Economist Intelligence Unit kalkulációi szerint a gyártókapacitások lassú felfutása miatt Afrikában csak jövőre tudják megkezdeni az oltásokat és csak 2024-re akakulhat ki védettség.
Kapcsolódó
A HVG szerint az amerikai elnöknek írt levélben név szerint ugyan nem szerepel Magyarország, ám ugyanezek a gyógyszergyártók az Egyesült Államok kereskedelmi képviseletét ellátó hivatalnak azt jelezték: a veszélyhelyzeti törvénnyel a magyar parlament lehetővé tette a gyógyszerészeti szabadalmak védelméről szóló nemzetközi egyezmény megkerülését.
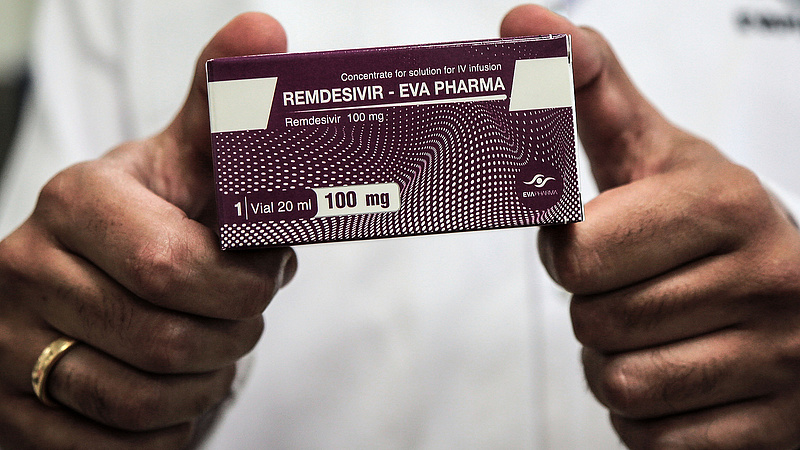
A beadványában a BIO példaként éppen a magyar kormány intézkedését hozta fel, amellyel lehetővé vált a remdesivir alkalmazása és magyarországi gyártása a covidos betegek kezelésére, és mindez - állításuk szerint - anélkül történt, hogy a kormány kapcsolatba lépett volna a szabadalom birtokosával. Ráadásul Magyarország az Európai Unión keresztül is hozzájuthatott volna a gyógyszerhez.
A HVG cikke megjegyzi, hogy a Richter októberben közölte, hogy a kormány fekérésére állami finanszírozással 5 hónap alatt megoldotta a hatóanyag szintézisét, és legyártott háromezer betegnek való remdesivirt. Az innovációs miniszter szerint ez 400 millió forintba került.
A Richter a HVG-nek azt mondta, hogy minden jogszabályt betartottak, és az infúziós gyógyszer generikus fejlesztése jelenleg is folyik az arra vonatkozó belső előírások szerint. A készítményt kutatás-fejlesztési tevékenység keretében állították elő, ennek célja a klinikai vizsgálatok elvégzése volt, amihez a Richter szerint nem kell előzetes egyeztetés a gyártóval. A Richter részéről ugyanakkor azt is megjegyezték, hogy a külföldiek által kifogásolt veszélyhelyzeti mechanizmus nem a gyártó kompetenciája, arról a kormány döntött.
Legolvasottabb

Titkolt fegyverüzlet: a kormány gyakorlatilag ajándékba adott 66 harckocsit Szerbiának

Óriási zuhanás a kutakon, ekkor érdemes tankolni

Megvan a NASA legújabb vezetője, el sem hiszi, honnan jött

Sára Botond már megtette az első lépéseket a Fővárossal szemben

Pénzes boríték helyett keserű szájíz: sok a dühös munkavállaló

Újabb fejlemények a Szőlő utcai ügyben: még egy nevelőnőt meggyanúsítottak, az igazgatót ma letartóztathatják

Hamarosan kiderül, ki a szerbek titokzatos megmentője

Megjött a döntés: ez történik csütörtöktől az üzemanyagárakkal

Orbán Viktor nem akar kártérítési rendszert, hiába a rémisztő botrány a Covid-vakcinák mellékhatási körül